เทโลเมียร์ คือ โปรตีนดีเอ็นเอป้องกันเชิงซ้อนซึ่งครอบปลายของปลายโครโมโซมยูคาริโอต และจำเป็นสำหรับความเสถียรของจีโนม เทโลเมอริกดีเอ็นเอที่สำคัญ ประกอบไปด้วยทางของอนุกรมคู่ซ้ำ ๆ กัน สั้น ๆ กำหนดและรักษาไว้ด้วยรีเวิร์สแทรนสคริปเทสซึ่งถูกควบคุมอย่างดีของเอนไซม์เซลล์เทโลเมอเรส เทโลเมอริกดีเอ็นเอนั้นอ่อนไหวต่อความเสียหายที่ปลายตามธรรมชาติผ่านทางขั้นตอนที่หลากหลาย รวมถึงปัญหาการแบ่งปลายของดีเอ็นเอ โครโมโซมเชิงเส้น ซึ่งทำให้เทโลเมียร์ สั้นลงทุกครั้งที่มีการแบ่งเซลล์ร่างกาย (Olovnikov 19773; Blackburn 2005) และขั้นตอนอื่นในเซลล์ซึ่งทำให้ความยาวเทโลเมียร์ (TL) ลดลง รวมทั้งพฤติกรรมของนิวคลีเอส การแบ่งตัวแบบ fork stalling ผ่านทางเส้นทางซ้ำ ๆ ของเทโลเมอริกดีเอ็นเอ การรวมตัวใหม่ของดีเอ็นเอ และความเสียหายจากออกซิเดชั่น (Jain and Cooper 2010)ในขณะที่เทโลเมอเรสสามารถหยุดการสั้นลงโดยการยืดออกและป้องกันตัวเอง กิจกรรมเทโลเมอเรสนั้นโดยทั่วไปแล้วจะเพิ่มการยับยั้งในเซลล์มนุษย์ทั่วไป (Blackburn 1997) เมื่อเทโลเมียร์สั้นลงเกินไป เซลล์จะแก่ตัว สูญเสียความสามารถในการแบ่งตัวและการทำงานปกติ (Allsopp et al. 1992; Blackburn 200; Armanios and Blackburn 2012) การกลายพันธุ์ซึ่งลดเทโลเมอเรสและทำให้เทโลเมอเรส ในมนุษย์สั้นลงทำให้เกิดสเปกตรัมของโรคที่เกิดก่อนวัยอันควร และสภาพที่โดยรวมเรียกว่า “เทโลเมียร์ซินโดรม” ซึ่งมีรูปแบบที่หลากหลายของโรคทั่วไปในการแก่ตัวของประชากรมนุษย์ (Armanios and Blackburn 2012)มีการศึกษาอิสระหลายฉบับค้นพบการซ่อมแซมความยาวที่เสียหายของเทโลเมอริกดีเอ็นเอว่าเกี่ยวข้องกับโรคหลากหลายชนิด และกับโรคที่เกี่ยวข้องกับอายุ เพื่อคาดเดาความเสี่ยงในอนาคตและผลกระทบรวมถึงศีลธรรม
- contact@telomeresciencethailand.com
- 081-831-9215 ID Line : livelong120
ภาพรวมของชีวภาพเทโลเมียร์
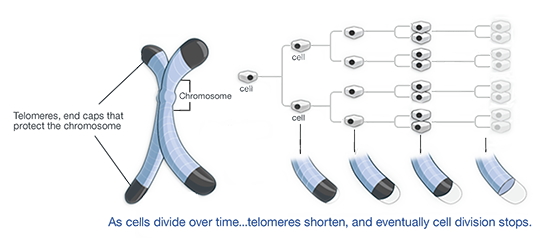
การศึกษาชีวภาพเทโลเมียร์ 3 อันดับแรก
การจัด mRNA ที่แก้ไขชั่วคราวเปลี่ยนเป็น TERT อย่างรวดเร็วทำให้ต่ออายุเทโลเมียร์ในเซลล์มนุษย์
ถูกเสนอเพื่อพัฒนาการปลูกเซลล์วิศวกรรมเนื้อเยื่อ และรักษาโรค อย่างไรก็ตาม การเสริมเทโลเมียร์โดยไม่ใช้ไวรัส หรือไม่บูรณาการยังไม่มีประสิทธิภาพ
ความผิดปกติของเทโลเมียร์ทำให้เกิดความแตกต่างของเม็ดเลือดที่ผิดปกติและไมอีโลดิสพลาสติกซินโดรม
ความเสี่ยงต่อไมอีโลดิสพลาสติกซินโดรม (MDS) นั้นเกี่ยวข้องกับการแก่ตัว ความเสียหายของดีเอ็นเอที่เกิดจากการบำบัด และ/หรือ เทโลเมียร์ที่สั้นลง แต่ยังไม่ทราบว่าการกัดกร่อนของเทโลเมียร์ทำให้เกิด MDS โดยตรงหรือไม่
การกลายพันธุ์ของเทโลเมอเรสในผู้สูบบุหรี่และถุงลมโป่งพองรุนแรง
การกลายพันธุ์ของยีนเทโลเมอเรสที่จำเป็น TERT และ TR ทำให้เกิดพังผืดในปอด อย่างไรก็ตามในหนูที่ไม่มีเทโลเมอเรส เทโลเมอเรสสั้นจะทำให้เกิดถุงลมโป่งพองหลังจากได้รับควันบุหรี่อย่างหนัก
บทความชีวภาพเทโลเมียร์แบ่งตามหัวข้อ
TELOMERE BIOLOGY MONTHLY GUEST BLOG

Calvin B Harley, Ph.D.
Telomere Diagnostics, Inc.
President & Chief Scientific Officer
Telomerase is not an oncogene
Telomerase is the critical enzyme in overcoming growth limitations due to telomere dysfunction, but it does not cause growth deregulation and hence is not an oncogene. There are, in fact, dozens of normal cell types that have been immortalized with telomerase without signs of cancerous changes, without altering differentiation capacity, and without altering preexisting genetic abnormalities. These observations suggest a range of opportunities for the use of telomerase immortalized cells in research, disease modeling, and drug discovery, as well as telomerase activation for treatment of certain age-related diseases. Even though telomerase-mediated prevention of cell senescence and/or genetic instability of pre-crisis cells may reduce the initiation or progression of cancers, caution is still warranted in telomerase activation therapies, as the theoretical risk of immortalizing or extending the lifespan of existing tumor cells must be weighed against the potential benefits.
Killing tumor cells in cancer patients with telomerase-based strategies has never before looked so promising. Despite the complexities of telomere dynamics on cancer initiation and progression in mice, and unresolved questions in humans, it seems clear that ‘remortalizing’ a lethal tumor through efective and specific telomerase inhibition, especially for tumors with short telomeres, will improve a patient’s prognosis. While advances continue to be made in the discovery of telomerase inhibitors, other approaches to specifically killing telomerase positive tumor cells have achieved experimental support. hTERT promoter-driven suicide genes have proven efective in vitro and in animal models, and therapeutic hTERT vaccine strategies are now in human clinical studies.
Although further research in this exciting new area of biology will undoubtedly help clarify mechanisms of action and point to better, safer, and more cost-effective therapeutic approaches, it is gratifying to finally see the light at the end of the tunnel for the development of much-needed medicines based upon the telomere hypothesis of cell aging and immortalization.
